Fecha 30 de Junio versión 1.0
Autores
Dona Benadof Médico Especialista en Laboratorio Clínico, Médico Jefe Laboratorio Clínico Hospital de Niños Roberto del Río
Carolina Prieto Médico especialista en Laboratorio Clínico, Presidenta ALAPAC/ML, Presidenta SMLC, Jefe de Laboratorio Central y Banco de Sangre Hospital Dipreca y Directora de Formato Clínico Chile
Carolina Selman Médico Especialista en Laboratorio Clínico, Subdirectora Unidades de Diagnóstico, Fundación Arturo López Pérez.
Cecilia Tapia Médico Especialista en Laboratorio Clínico, Médico Asesor en Microbiología y Biología Molecular, Red de laboratorios Banmédica.
Revisor
Claudio Suárez Médico Especialista en Laboratorio Clínico Director de Asuntos Médicos DX, Siemens Healthineers.
Índice
- Introducción
- Selección de un test serológico
- Tipos de muestra
- Verificación de test serológicos y control de calidad
- Interpretación e informe de resultados
- Otras recomendaciones generales
- Referencias
Introducción
Es un desafío realizar la selección de un test serológico en tiempos de pandemia. Básicamente hay dos incógnitas a resolver frente a un nuevo virus que corresponden a: la antigenicidad del virus y la respuesta inmune del hospedero. Estos dos elementos se deben considerar en el momento de la fabricación de kits de reactivos, y en el momento de probar la utilidad en la población en tiempos de pandemia, en que la producción de kits se ve estresada por la necesidad clínica. El diagnóstico serológico es una herramienta útil para entender la expansión poblacional de COVID 19 en la comunidad y para identificar individuos inmunes que potencialmente podrían estar protegidos de hacer una nueva infección por el virus.
En el mercado existen kits de detección de anticuerpos IgA, IgM, IgG y Total para SARS Cov 2. Los hay en formato de inmunocromatografía o también llamados test rápidos con resultados en 15 minutos, así como en formato de ELISA o quimioluminiscencia que son más sensibles y específicos. NO todos los Kits que circulan en el mercado están aprobados por la FDA, y de tener autorización han pasado por un proceso llamado de “autorización de emergencia” en el contexto de pandemia lo que hace que las compañías puedan producir sus kits para uso clínico sin la suficiente información que pediría la organización para aprobación en condiciones de NO emergencia sanitaria.
Con respecto a estos marcadores serológicos se puede decir que los anticuerpos comienzan a aumentar desde la segunda semana una vez iniciados los síntomas, aunque se describen casos con IgM a IgG desde tan precoz como el 4 día de evolución de síntomas, los niveles más altos detectados son consistentemente entre la segunda y tercera semana. Luego IgM comienza a bajar desde la semana 5 casi desapareciendo en la semana 7 después de iniciados los síntomas.

Básicamente hay dos tipos de categorías de tests mencionados en párrafos anteriores,
¿cómo funcionan?: Los tests basados en métodos de enzimoinmunoensayo que utilizan como muestra plasma, o suero del paciente. Esta muestra es depositada en un pocillo que tiene alojado proteínas virales, si la muestra del paciente tiene anticuerpos contra el virus estos se unirán a las proteínas formando complejos, estos serán detectados por anticuerpos marcados con, por ejemplo, fluorescencia contra el fragmento FC de la Inmunoglobulina fijada, y así puede ser detectada la señal y puede ser hasta cuantificada según la magnitud de la marcación detectada. Estos exámenes se hacen dentro de un laboratorio en equipos destinados para serología habitualmente y demoran horas hasta días .
Los tests rápidos usan formato de inmunocromatografía o lateral flow assay (LFA), el principio de detección es similar a un enzimoinmunoensayo pero en un formato parecido al de un test de embarazo, la muestra es sangre total de punción digital, plasma o suero, que una vez aplicada al dispositivo fluye a través de una tira que tiene partículas virales inmovilizadas en su superficie. Si la muestra tiene anticuerpos estos se unirán a las proteínas formando complejos que quedarán inmovilizados en la tira que si superan en cantidad un umbral definido según cada marca generará líneas coloreadas que indican un resultado positivo. En estos tests el resultado es positivo o negativo , la lectura debe realizarse en el momento exacto definido en el inserto, por tanto es una técnica que requiere tantos timers como sea posible mantener una trazabilidad paciente-muestra-kit
La utilidad de un test del punto de vista clínico depende de la sensibilidad y especificidad, para búsqueda de inmunidad y seroprevalencia es deseable tener un test con más de un 90% de sensibilidad y 98% de especificidad
Es importante considerar en especificidad y sensibilidad analitica que la mayoría de los anticuerpos se producen contra las proteínas virales abundantes, que en este caso es nucleocápside, se subentiende que entonces que los test diseñados con estos antígenos deberían ser más sensibles , pero el receptor-binding domain of Spike (RBD-S) protein que se aloja en la porción S1 de la proteina Spike aparece como inmunodominante y genera anticuerpos altamente específicos y se espera que probablemente sean neutralizantes .Por lo que utilizar una o ambas de estas proteínas como antígenos en los test implicaría una alta sensibilidad. También puede haber reactividad cruzada con SARS-COV, MERS y otros coronavirus humanos, así como las activaciones policlonales en enfermedades infecciosas severas pueden generar falsos positivos. Estos tests rápidos lamentablemente tienen una alta variabilidad de punto de vista de la calidad y sensibilidad, en el contexto que los productores de los reactivos no indican siempre la naturaleza ni la pureza del antígeno utilizado.
Tipos de muestra
Los tests serológicos pueden usar diferentes tipos de muestras según la modalidad que sean. Los tests de tipo Inmunocromatográficos, de flujo lateral o “tests rápidos”, normalmente utilizan una muestra de sangre total capilar o venosa, o también pueden usar muestras de suero o plasma, para determinar la presencia de anticuerpos contra SARS-CoV-2 de tipo IgM, IgA y/o IgG, siempre que el inserto lo señale o esté validado para su uso. El caso de la IgA este anticuerpo normalmente tiene importancia para la inmunidad de mucosas y podría estar presente en muestras de saliva, pero en el caso de COVID-19 su significancia aún está por determinarse. Los tests de ELISA o CLIA utilizan normalmente muestras de suero o plasma para la determinación de anticuerpos y estas requieren una separación por centrifugación antes de procesar.
Tabla: Las ventajas/desventajas de cada muestra en test Serológicos, se muestran a continuación en forma comparativa
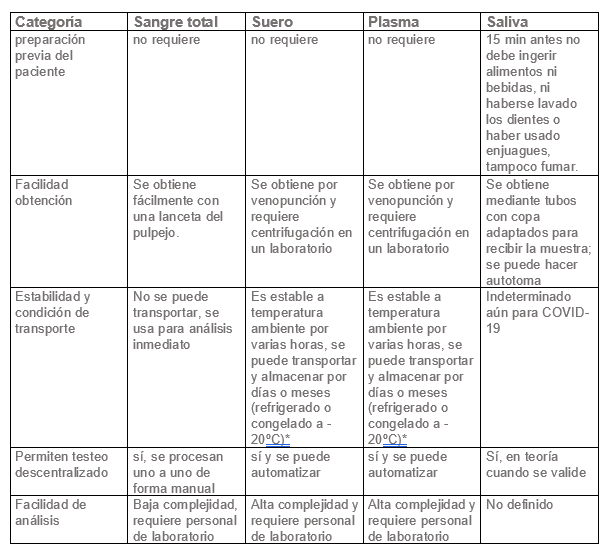
* debe seguir las recomendaciones del fabricante del test en que se procesa
Verificación de test serológicos y control de calidad
En febrero de 2020, la Food and Drugs Administration (FDA), organismo regulador de tests y dispositivos aprobó el uso de algunas pruebas de diagnóstico para COVID-19, que incluyen tests moleculares, de antígeno y anticuerpos, como de emergencia, debido a que se trataba de una infección reciente y poco conocida (Emergency Use Authorizations, EUAs) (1). Con el transcurso del tiempo, y debido a que el desempeño de las pruebas es sumamente variable y no se conoce el completamente comportamiento de la enfermedad, ni la seroprevalencia, la FDA publicó el desempeño analítico de algunos kits inmunocromatografía y técnicas en equipos de alto rendimiento, asumiendo una seroprevalencia del 5% en la población general y que permiten conocer el VPP y VPN de estas, además de sensibilidad y especificidad. Cada una de estas pruebas cuenta con estudios propios y variables de desempeño. (2). Por otra parte, varias de estas pruebas
pasaron el marcado de la CE Conformité Européenne" o de Conformidad Europea) (3) y pueden ser usadas en pacientes.
La verificación de método es parte importante en la incorporación de cualquier prueba diagnóstica al laboratorio. Consiste en comprobar que se está haciendo correctamente esta prueba, al comprobar parámetros de desempeño recomendados por el fabricante (4). La verificación permite caracterizar cualitativa y cuantitativamente el rendimiento de la prueba y de esta manera evaluar si el test es aceptable para su uso en rutina, si re requieren más estudios de verificación, si se requiere una acción correctiva inmediata. El trabajo de verificación ayuda a garantizar resultados de pruebas confiables y contribuye a una mejor comparabilidad de las pruebas moleculares y las pruebas y los sistemas de prueba (4).
Los pasos de la verificación son:
- diseño del estudio (protocolo): material de estudio (tipo de muestras, controles comerciales), número de muestras a procesar, criterios de aceptabilidad
- verificación propiamente tal: método de estudio (para Inmunoglobulinas ELISA, inmunocromatografía), análisis estadístico (test de Fisher y/o Chi cuadrado) y
- datos adicionales: comparación con método anterior (correlación, curvas de Bland-Altman, test de t-student).
Debido a la diversidad de kits disponibles, es importante verificar cada prueba de inmunoglobulina para SARS-CoV-2, independiente a que esté recomendada para su uso por el Instituto de Salud Pública (ISP). En el caso de las inmunoglobulinas para SARS-Cov-2, los parámetros de desempeño que indica el fabricante son la sensibilidad y especificidad clínica. De acuerdo a la literatura el mejor desempeño de las pruebas de anticuerpos es después de los 14 días de cursar con una PCR positiva. Si se cuenta con los recursos necesarios, es ideal evaluar la prueba en distintos tiempos de PCR positiva, por ejemplo, de 0-10 días, de 11-14 días y > 14 días (5). Si esto no es posible se recomienda evaluar a partir del día 11, para mejorar el desempeño de las técnicas.
Cabe señalar que antes de verificar un tests inmunocromatográfico es necesario revisar las guías de interpretación del fabricante y/o aquellas acordadas localmente, especialmente para resultados dudosos. Con los resultados obtenidos, se realiza una tabla de contingencia y se calculan la sensibilidad y especificidad clínicas comparadas al resultado de la PCR.
En el caso de las pruebas cuantitativas, se recomienda además evaluar al menos precisión analítica en un nivel de control positivo, idealmente próximo a un nivel de decisión médica mediante protocolo EP15-A3, de la CLSI (6). a. Se debe realizar la calibración de la técnica según indicaciones del fabricante y el control de calidad diario. Luego, procesar una corrida diaria de 5 replicados de control positivo y repetir este procedimiento durante 5 días consecutivos, se calcula el Coeficiente de Variación en Condición de Repetibilidad (CVR) y el Coeficiente de Variación en Condición
Intralaboratorio (CVWL). Posteriormente se evalúan posibles desviaciones en los
resultados durante la verificación, en relación a lo declarado por el fabricante, mediante una comparación estadística usando la prueba ANOVA.
Control de Calidad de los estudios serológicos:
Las pruebas inmunocromatográficas de anticuerpos cuentan con un control interno de reacción, que siempre deben dar positivo antes de informar una prueba.
Por el momento existe escasa disponibilidad en el mercado de controles de tercera opinión para estas pruebas. Lo ideal sería contar con un control para utilizar cada vez que se abre un kit y/o al cambiar el lote de reactivo.
También pudieran utilizarse pool de plasmas o sueros preparados en laboratorio con muestras positivas, valorados localmente. También se recomienda participar en programas de control de calidad externo nacionales o internacionales. Lo mismo se recomienda para tests cuantitativos del tipo monotest (tests individuales).
Las pruebas cuantitativas tipo ELISA o quimioluminiscencia en “batch”, en general cuentan con dos niveles de control para realizar el control de calidad diario. En estos casos también pueden usarse pool de plasmas o sueros valorados localmente. Se recomienda la participación en programas de control de calidad externo nacionales o internacionales o programas de intercomparación, en la medida de lo posible.
Interpretación de resultados y utilidad Clínica de la Serología de SarSCov2 Optimización Valor Predictivo Positivo (VPP)
Especificidad y prevalencia (probabilidad pretest) son determinantes para la obtención de un VPP alto. Una alta especificidad (99.5%) implica una baja reactividad cruzada, lo que se traduce en una baja probabilidad de falsos positivos. En la actualidad para SarSCov2 los distintos test reportan una especificidad superior al 80% con poca reactividad cruzada con SarsCov.
Asegurada la especificidad alta de acuerdo a la declaración del fabricante del ensayo, se debe considerar la prevalencia de la enfermedad (probabilidad pre-test para detectar los anticuerpos) para incrementar el VPP.
La probabilidad pre-test puede aumentarse de acuerdo a quien se decida hacer el ensayo. La probabilidad de detectar anticuerpos será mayor en aquella persona sintomática, con antecedente contacto con un paciente COVID-19, y que consulta tardíamente tras el inicio de síntomas, comparado con aquella persona asintomática y sin contacto reconocido con un paciente COVID-19
Optimización Valor Predictivo Negativo (VPN)
Al igual que VPP, especificidad y prevalencia (probabilidad pretest) son importantes para la obtención de un VPN alto, pero la sensibilidad es primordial para ello. En el contexto serológico, se debe tener presente el periodo ventana de seroconversión para la correcta interpretación. En la actualidad se ha reportado una sensibilidad variable según el tipo de
test presente en el mercado, ya sea IVD (para diagnóstico In vitro), RUO (para investigación) o In house (creación propia).
Una baja prevalencia de la enfermedad, es un escenario para un VPN optimizado. Un ejemplo de VPN alto sería la obtención de un resultado negativo en una persona asintomática y que no ha tenido contacto con personas COVID-19 en los últimos 14 días.
Interpretación Serología SARS-CoV-2
Para la correcta interpretación de los resultados de pruebas serológicas de SARS CoV 2 es muy importante tener en cuenta que más que para diagnóstico de la enfermedad, estos test sirven para evaluar respuesta inmune del individuo contra el virus SARS-CoV-2, es decir, informan sobre un contacto previo o en curso.
La interpretación adecuada de los resultados serológicos debe ser realizada de forma cuidadosa y teniendo en cuenta:
- El momento en el cual se toma la muestra(días desde el contagio y/o inicio de síntomas) y la calidad de dicha muestra como fue explicitado
- Tipo de test a utilizar
En cuanto al momento en el cual se toma la muestra, en el caso de p acientes
sintomáticos, un resultado de serología negativo durante los primeros 7 días de enfermedad no puede ser usado como criterio para descartar un caso, dado que los anticuerpos contra el virus son detectables alrededor del día 7 desde el inicio de síntomas. Un resultado positivo después del día 7 indica un contacto previo cuya temporalidad debe analizarse según anamnesis,
En el caso de contactos estrechos de casos confirmados, independientemente del resultado serológico, se deberá dejar en cuarentena al menos por 14 días desde el contacto con el caso confirmado. En estos casos no se sugiere la realización de un test serológico hasta idealmente terminada la cuarentena, en donde un caso positivo indicará contacto viral cuya temporalidad debe analizarse según anamnesis.
En el caso de individuos asintomáticos la presencia viral hizo que desarrollara anticuerpos, sin embargo no necesariamente síntomas. Por esto, aunque la serología positiva en individuos sanos indica contacto previo, no permite inferir el momento del contacto. Algunos individuos desarrollan anticuerpos IgM muy tarde después del contacto y no es claro aún por cuánto tiempo pueden ser detectados. Asimismo, la IgG se puede elevar al mismo tiempo que la IgM, por lo que la detección de los dos anticuerpos al mismo tiempo o la detección de sólo de uno de ellos (IgM o IgG) no es un criterio adecuado para definir el tiempo de un posible contacto. Además, no hay evidencia suficiente para asegurar que los anticuerpos presentes son en realidad protectores o durante cuánto tiempo. El uso de la serología en estos casos será con fines de
investigación o para determinación de seroprevalencia en una población dada, pero no deben ser utilizados como criterio único de diagnóstico (10).
En relación al tipo de test a utilizar, el 20 de abril del 2020 la OMS lanzó un comunicado indicando que los test serológicos “rápidos” debían utilizarse sólo en el contexto de investigación, y no como determinantes de una decisión clínica (11); por lo tanto, idealmente se debe preferir metodologías cuantitativas, las que se encuentran en distintos formatos.
En cuanto a la interpretación de los resultados, la FDA ha entregado autorizaciones transitorias producto de la pandemia a distintas empresas productoras de test las cuales han utilizado metodología distintas para determinación de anticuerpos, en donde se considera un resultado positivo a una razón en relación a un estándar. Esto hace que no sea posible la cuantificación de anticuerpos presentes ni tampoco la armonización de resultados entre los distintos fabricantes. El valor de titulación de anticuerpos debe interpretarse con precaución según el uso que quiera dársele. En cuanto al tipo de anticuerpo evaluado, hay metodologías que ven IgM, IgG,IgA, y anticuerpos totales. El uso de uno por sobre otro aún no se encuentra totalmente dilucidado para este test, sin embargo IgM e IgG se siguen utilizando como metodología para evaluar seroconversión.
Para la interpretación de los resultados en relación a la temporalidad de la enfermedad se sugiere siempre correlacionar siempre la presencia de anticuerpos con el cuadro clínico (sintomatología) y PCR.
Otras recomendaciones generales:
- Los exámenes de laboratorio de este tipo, inclusive los de versión rápida no deben ser auto indicados, lo debe siempre indicar un médico de acuerdo a nuestra legislación.
- Toda la serología disponible hasta este momento es para uso profesional, por tanto no se recomienda el autotesteo, es decir realizar el test por personas que no son del àrea de laboratorio clínico.
- No se recomienda la autointerpretación por parte del paciente, pues lo debe interpretar un médico dentro del contexto clínico.
- Los médicos clínicos deben recurrir a los profesionales de laboratorio para interpretar casos discordantes con la clínica.
- Es muy importante estandarizar y hacer un buen análisis de riesgos de las fases preanalítica, analítica y postanalítica en la implementación de estos exámenes serológicos y conocer muy bien su desempeño analítico y clínico.
Referencias
- https://www.cdc.gov/coronavirus/2019-ncov/lab/serology-testing.html
- Interpreting Diagnostic Tests for SARS-CoV-2 JAMA June 9 2020, vol 323 num 22
- Recomendaciones SEIMC sobre el uso de pruebas de detección de anticuerpos Abril 2020
- https://www.fda.gov/medical-devices/emergency-use-authorizations-medical-device
s/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devic
thorized-serology-test-performance
- https://ec.europa.eu/growth/single-market/ce-marking_en
- Burd EM. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 2010;23(3):550-576.
- Paiva KJ, Grisson RD, Chan PA, Lonks JR, King E, Huard RC, Pytel-Parenteau DL, Nam GH, Yakirevich E, Lu S. Validation and Performance Comparison of Three SARS-CoV-2 Antibody bioRxiv 2020.05.29.124776; doi:
https://doi.org/10.1101/2020.05.29.124776
- User Verification of Precision and Estimation of Bias, 3rd Edition. CLSI.org
- Pan American Health Organization / World Health Organization. Laboratory Guidelines for the Detection and Diagnosis of COVID-19 Virus Infection. Washington, DC: PAHO / WHO; 2020. Available from: https://paho.org/en/documents/laboratory-guidelines-detection-and-diagnosis- covid-19- virus-infection.
- World Health Organization. Advice on the use of point-of-care immunodiagnostic tests for COVID-19. Scientific brief. Geneva: WHO; 2020. Available from:
https://www.who.int/newsroom/commentaries/detail/advice-on-the-use-of-point-of-c
